百蓁生物技术(武汉)有限公司
3 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
技术资料/正文
文献解析丨从头测序(denovo sequencig)和氢氘交换质谱(HDX-MS)助力抗原抗体表位发现
51 人阅读发布时间:2025-02-18 10:00
化脓性链球菌(Streptococcus pyogenes)又称A族链球菌(Group A Streptococci,GAS),是一种可引起从普通非侵袭性疾病如咽炎、猩红热、脓疱病到侵袭性和严重侵袭性疾病如风湿热、链球菌感染性肾小球肾炎、坏死性筋膜炎、中毒休克综合征等疾病的常见人类专性致病菌。在链球菌感染的疾病中,约90%是由GAS引起的,GAS感染及感染后的变态反应与多种毒力因子有关,其中GAS产生的链球菌溶血素O(streptolysin O,SLO)能够使细胞膜产生大的孔道,毒蛋白进入细胞质,对细胞产生毒性作用。SLO高度保守,在全球98%以上的GAS分离株中都有发现,这使SLO成为一种有前景的疫苗候选者。然而,迄今为止还没有关于具有靶向SLO的特征性一级结构的保护性单克隆抗体的报道,这阻碍了保护性表位的鉴定。
今天为大家分享一篇2024年5月发表在Analytical Chemistry(IF6.7)上的文章“Multimodal Mass Spectrometry Identifies a Conserved Protective Epitope in S. pyogenes Streptolysin O”。研究者提出了一种新的多模式质谱策略,并对中和单克隆抗体进行了从头测序,通过研究天然状态的SLO抗体复合物来确定保护性表位。该表位位于结构域3,在>98%的GAS基因组中是保守的。这项研究表明从头测序和多模式质谱作为一种多功能和有前景的策略,可用于鉴定细菌抗原中的保护性表位。

研究方法
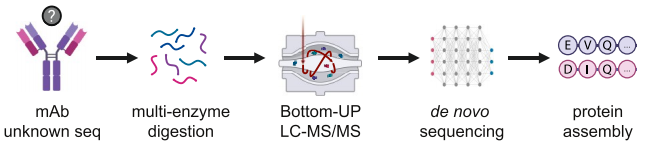
1、使用从头测序来确定mAb的一级结构
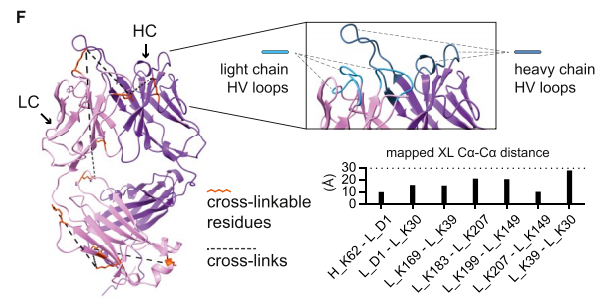
2、使用XL-MS来产生距离来鉴定抗原-抗体复合物内的约束距离
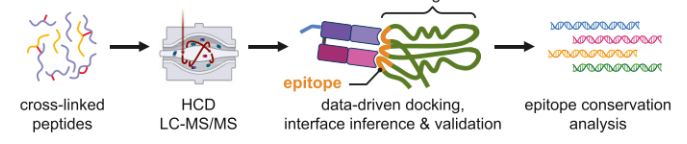
3、建立基于距离信息驱动的SLO Fab复合体界面预测模型,以预测Fab区域和抗原结合界面中最重要的残基
4、通过HDX-MS和表位的逆向工程进行实验验证
研究结果
一、中和单克隆抗体的De Novo测序和建模。
研究者首先发现了一种单克隆抗体,其序列未公开,通过Elisa实验证明这种单克隆抗体能够中和SLO介导的细胞溶解。并且证明GAS感染后可以产生中和抗体,中和作用仅由Fab结构域介导。
为了获得nAb的完整氨基酸序列,使用四种具有不同切割位点特异性的蛋白酶消化抗体,并使用基于三个不同搜索引擎的组合从头测序策略对蛋白水解重叠的nAb肽片段进行测序。将重叠的肽片段组装成高置信度的全长序列,包括参与轻链和重链抗原结合的互补决定区(CDR),然后对Fab结构域的三级结构进行建模。
二、XL-MS结合位点的接近和相互作用分析的表位推断
为了鉴定nAb靶向的表位,将SLO与nAb孵育,然后使用二琥珀酰亚胺戊二酸(DSG)或二琥珀酰亚油酸(DSS)进行交联反应。随后的质谱分析确定了SLO Fab/LC之间的五对交联肽和SLO Fab/HC之间的三对交联肽。结合界面的距离约束对于指导抗体-抗原复合物的建模和提高深度学习算法的准确性非常重要。为了选择信息量最大的距离约束,DisVis快速扫描分析用于识别蛋白质间交联(XLs),在SLO(PDB:4HSC)的晶体结构上突出显示该区域,表明该表位是不连续的位于结构域3内,由3个α螺旋和2个β-折叠组成。
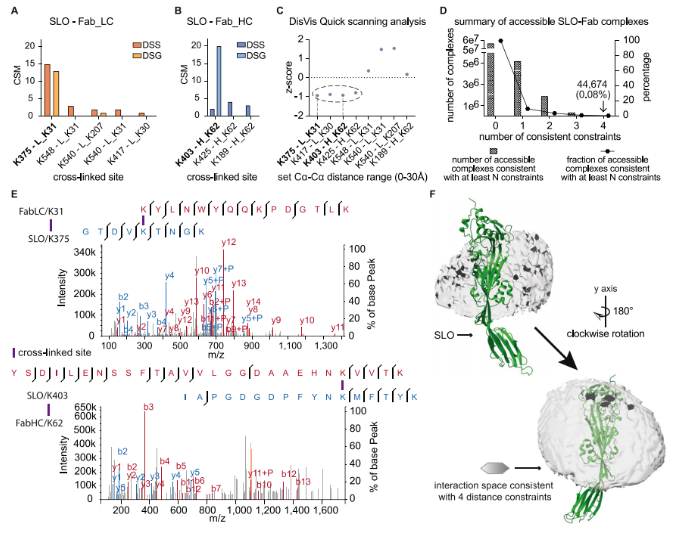
三、基于距离信息驱动的SLO Fab复合体界面预测模型
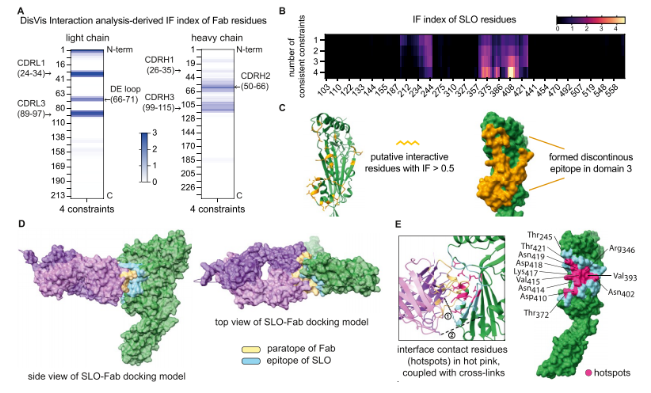
DisVis分析、IF指数以及获得的XL距离约束能够预测位于SLO结构域3中的松散定义的表位。为了进一步确定相互作用位点,研究者使用了HADDOCK 2.4抗原-抗体对接方案。该分析特别表明,SLO中的残基Thr245、Arg346、Thr372、Val393、Asn402、Asp410、Asn414、Val415、Lys417、Asp418、Asn419和Thr421在形成SLO和nAb Fab结构域之间的结合界面方面起着重要作用。
四、应用HDX-MS验证XL-MS衍生的表位和对接方法。
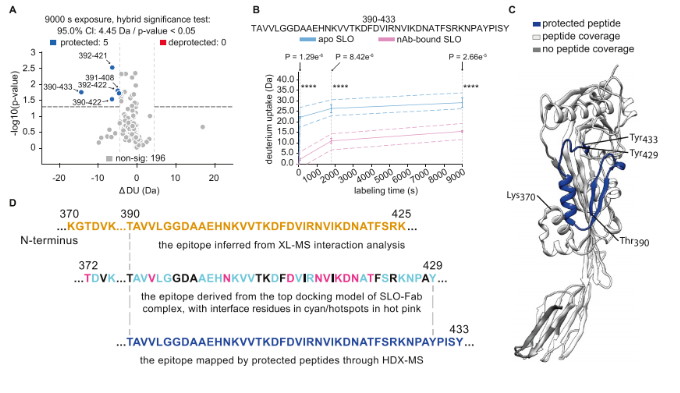
为了验证距离信息驱动对接的结果,使用HDX-MS研究了SLO残基与nAb结合时氘摄取的变化,并进一步研究了nAb结合后SLO蛋白动力学的变化。HDX-MS实验生成了202种常见肽的高置信度注释,对应95.7%的序列覆盖率和高度重叠。每个鉴定的肽在四个氘化间隔(0、60、1800和9000秒)内氘摄取(ΔDU)的变化被汇总并显示在蝶形图中。总体而言,除了从Thr390到Phe409的肽,未结合SLO和nAb结合SLO状态之间的氘摄取变化很小。杂交显著性检验确定了跨越390−422、390−433、391−408、392−421和392−422的SLO肽在与nAb相互作用期间受到显著保护。动力学图显示了一种代表性肽(390−433)在所有氘化间隔内的氘摄取变化,其显著性水平表明由于nAb结合而具有保护作用。受保护的肽都位于SLO的结构域3中,与XL-MS相互作用分析和SLO-Fab复合物对接模型预测的表位几乎完全重叠。HDX-MS结果也可用于排除代表性较低的XLs。在我们的案例中,HDX-MS数据不支持先前实验中确定的几个距离约束(SLO/K548-FabLC/K31、SLO/K540-FabLC/K31,SLO/K540FabLC/K207和SLO/K189-FabHC/K62)所指示的相互作用位点,这些位点可能是溶液中XL-MS捕获的较弱或瞬态相互作用。重要的是,HDX-MS结果进一步表明,SLO在nAb结合后不会发生重大的构象变化。
五、使用逆向工程结构评估表位识别置信度
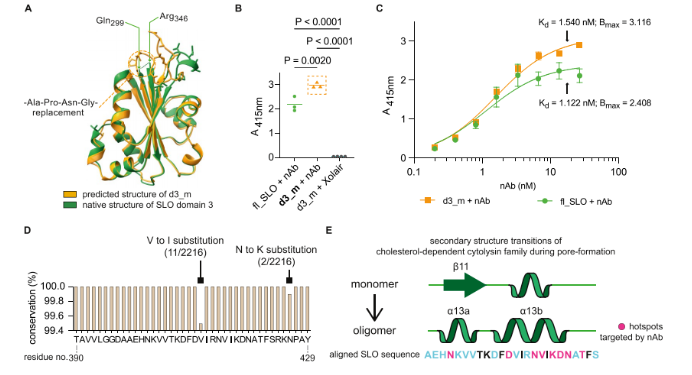
最后,研究者重新设计并产生了一种新的蛋白质构建体,称为d3_m,以验证所鉴定的不连续表位足以结合nAb。使用计算机稳定分析来合并XLMS和HDX-MS鉴定的结构域3的两个不连续区域,方法是用四个氨基酸的较短接头序列(Ala−Pro−Asn−Gly)替换Gln299−Gly345的拉伸区域。d3_m结构的建模揭示了与天然结构域3的高度结构相似性。AlphaFold2预测模型显示,与原始结构的均方根方差(RMSD)为0.714Å,表明排列紧密(图5A)。为了确定nAb是否可以识别这种新修饰的构建体,我们从大肠杆菌中表达并纯化了d3_m,并使用间接ELISA评估了结合特异性。与全长SLO相比,nAb以相同的方式特异性结合d3_m,而无关的IgG1没有显示出结合特异性(图5B)。此外,通过非线性回归分析确定的平衡解离常数Kd表明,与d3_m的结合相比,nAb与完整SLO的结合略强(图5C)。另一方面,d3_m的Bmax(最大特异性结合)值越高,表明nAb在这种新型构建体上的表位可及性越好。
小结
在这项研究中,通过以下方式证明了蛋白质质谱的多功能性:(i)对抑制SLO介导的细胞溶解的中和单克隆抗体进行从头测序;(ii)使用XL-MS和HDX-MS的正交能力,结合综合计算模型,鉴定抗原-抗体复合物中天然状态的保护性表位。这项研究强调了多模式MS策略在鉴定表位、研究抗体结合模式和分析各种细菌抗原之间的蛋白质相互作用方面的潜力。
参考文献
Tang, Di, et al. "Multimodal Mass Spectrometry Identifies a Conserved Protective Epitope in S. pyogenes Streptolysin O." Analytical Chemistry 96.22 (2024): 9060-9068.




