百蓁生物技术(武汉)有限公司
3 年
手机商铺
- NaN
- 0.5
- 1.5
- 0.5
- 3.5
技术资料/正文
PEAKS助力乳腺癌新抗原精准发现
198 人阅读发布时间:2024-05-28 11:00
乳腺癌是女性乳房组织中发生的一种恶性肿瘤,尽管男性也可能患有乳腺癌,但女性是其主要发病人群,占所有女性癌症发病的约25%;尽管在过去的几十年治疗有很大进展,但转移性乳腺癌仍然是无法治愈的。从免疫学的角度来看,激素受体阳性乳腺癌(HR+)被认为是免疫上“冷”肿瘤,并没有受益于最近的免疫治疗进展。相比之下,三阴性乳腺癌(TNBC)亚型在免疫上属于“热”肿瘤。白细胞浸润和对免疫检查点封锁(ICB)的反应性证明了这一点。HR+和TNBC肿瘤免疫原性差异的原因尚不清楚,CD8+ T细胞是抗肿瘤反应的主要效应器,可识别MHC I相关肽(MAPs),HR+和TNBC中MAP库的差异或许可解释这种差异。

2024年1月,加拿大蒙特利尔大学的Pierre Thibault教授课题组在The Journal of Clinical Investigation上发表了题为“Breast cancer immunopeptidomes contain numerous shared tumor antigens”的文章,该文章使用质谱法,对26例原发性乳腺癌样本进行了全面的蛋白质基因组学分析。研究者利用每个样本的RNA-Seq数据建立了包含内源性逆转录因子(ERE)蛋白质组、smRNA蛋白质组、及癌症特异性蛋白质组的个性化参考数据库,利用PEAKS软件对每个样本的质谱数据鉴定出共57094个MHC I相关肽。接下来,将乳腺癌TCGA样本分为异常表达的肿瘤特异性新抗原 (aeTSAs)数量高和低两组,并对两组进行差异基因表达分析,通过白细胞浸润基因标记进行基因集富集分析(GSEA)阐述了异常表达肿瘤新抗原(aeTSAs)的免疫浸润结果。本研究还进行了特异性T细胞功能扩增(FEST)试验评估了鉴定抗原的免疫原性以及总生存率分析评估了肿瘤相关抗原(TAAs)和异常表达肿瘤特异性新抗原(aeTSAs)的数量是否与TCGA中患者的总生存期相关。
研究方法
该研究选取了26例原发性乳腺癌样本:HR+ (ER或PR阳性,HER2阴性;n=14)或TNBC (ER/PR/HER2阴性;n=12),肿瘤组织通过免疫沉淀获得MHC I免疫组,通过RNA-seq构建个性化数据库,并使用PEAKS X Pro在相关数据库中检索LC-MS/MS数据(方法如下图所示),随后对鉴定出的免疫肽进行差异基因表达分析,免疫原性分析,特异性T细胞功能扩增(FEST)试验以及TAAs和aeTSAs的数量是否与TCGA中患者的总生存期相关分析。
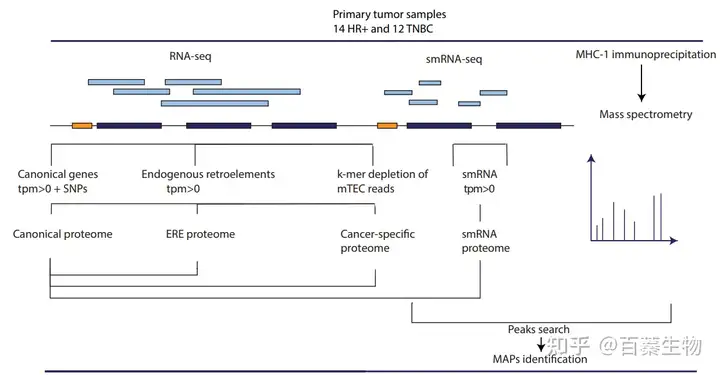
数据搜索的工程流程
研究结果
- HR+和TNBC肿瘤的典型免疫肽组相似
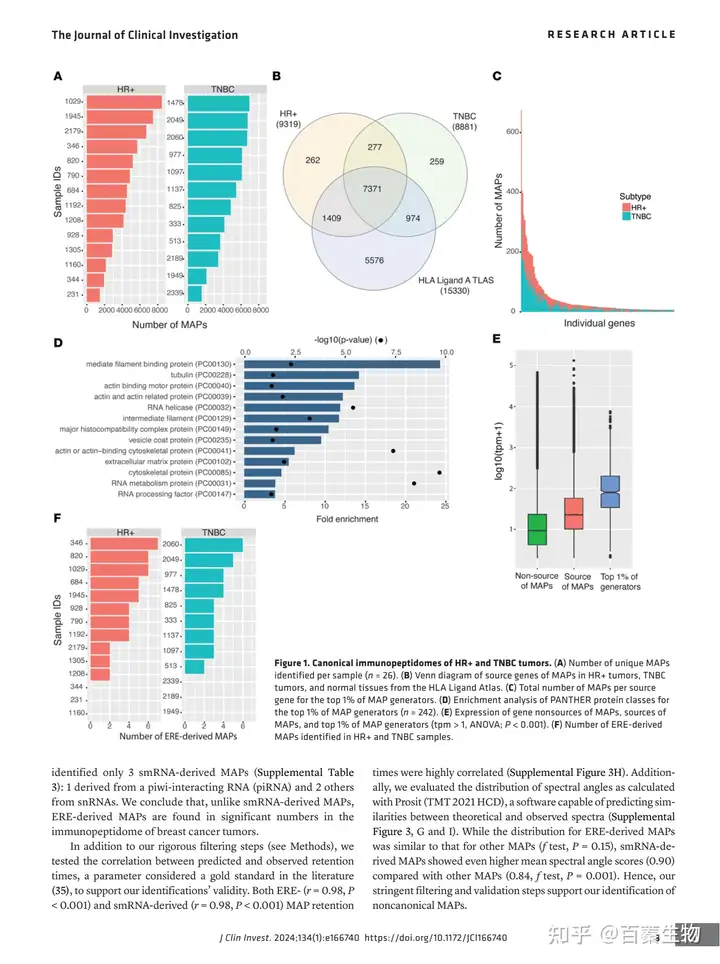
研究者从未经治疗患者的26例原发性乳腺癌样本中鉴定出57094个典型MAPs。每个肿瘤样本的MAPs平均数目为4633个,HR+和TNBC样本之间无统计学差异(图1A)。研究发现,HR+和TNBC肿瘤中MAP产生的相同源基因比例较高(72.5%,n = 7648)(图1B),其中大部分(92%,n = 9754)在正常组织HLA配体中也被报道为MAP源基因。虽然数据集中49%的源基因生成了5个或更少的MAPs,51%的源基因生成了5个以上的MAPs,63个基因编码了100多个MAPs(图1C)。前1%的MAP源基因显著富集于细胞骨架蛋白和细胞外基质蛋白类(图1D),比其他免疫肽贡献者表达出更高的基因(图1E)。这揭示了HR+和TNBC样本的典型免疫肽段之间的大量重叠,以及来自细胞骨架蛋白和细胞外基质蛋白的MAPs的显著富集。
- 潜在治疗靶点的识别:肿瘤相关性抗原TAAs,异常表达的肿瘤特异性新抗原aeTSAs和突变的肿瘤特异性抗原mTSAs
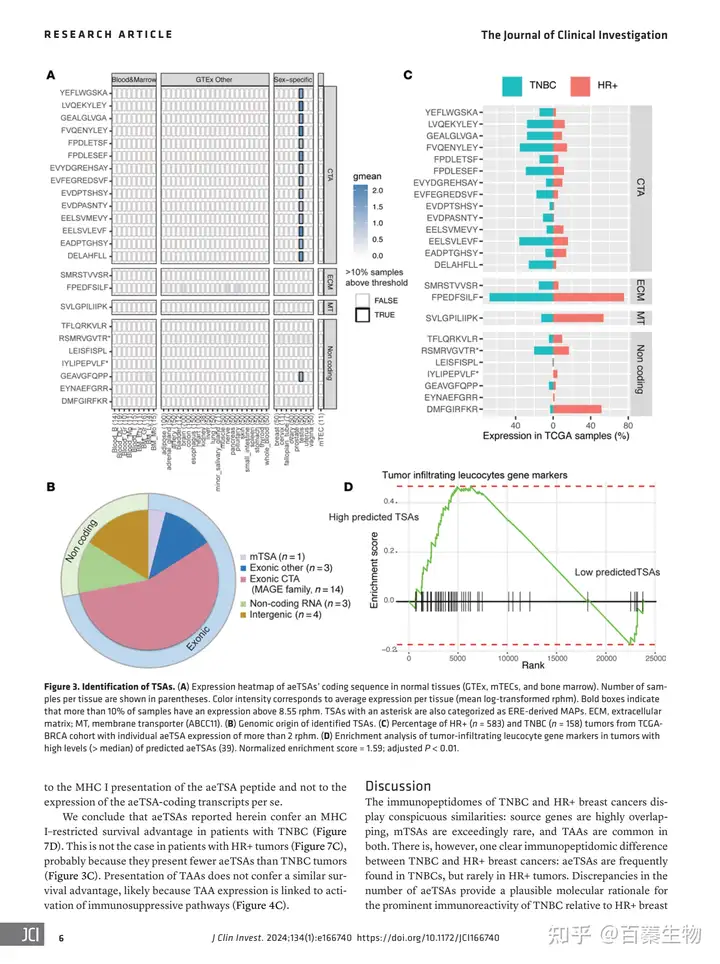
作者利用大型免疫肽数据集来发现假定的乳腺癌MAP,MAPs of interest (MOIs)被分类为TAAs、aeTSAs或mTSAs,工作流程如图2A所示。最终,该研究确定了25个TSA(1个mTSA、24个aeTSA)和49种TAAs,其中大部分未被列入免疫表位数据库(IEDB)(图2B、C)。

- TSAs在TNBC中比HR+乳腺癌更丰富
在24个aeTSAs中,17个由典型外显子编码:14个来源于癌胚抗原(CTA)的MAGE family CTAs家族,2个来源于编码细胞外基质成分的基因(COL11A1, ITH6),1个来源于跨膜蛋白编码基因(ABCC11);7个aeTSAs来源于非蛋白质编码区,2个与EREs重合,为ERE-derived MAP(图3)。统计发现,TNBC样品中aeTSAs 更丰富(图2 B)。研究者进一步评估TNBC样本中aeTSAs的丰富鉴定是否与TCGA队列中的TSA表达相关。在TNBC中,表达癌胚抗原 (CTA)类肿瘤个体aeTSAs的比例高于HR+肿瘤(19%比8%,P = 0.004)(图3C)。将乳腺癌TCGA样本分为高(高于中位数)和低(低于中位数)aeTSAs数量两组,使用白细胞浸润标记基因进行GSEA分析,结果显示,这些基因在高TSA数量的肿瘤中富集(图3D),这表明一些TSAs在体内具有免疫原性。
- TAAs在乳腺癌中有很高的比例
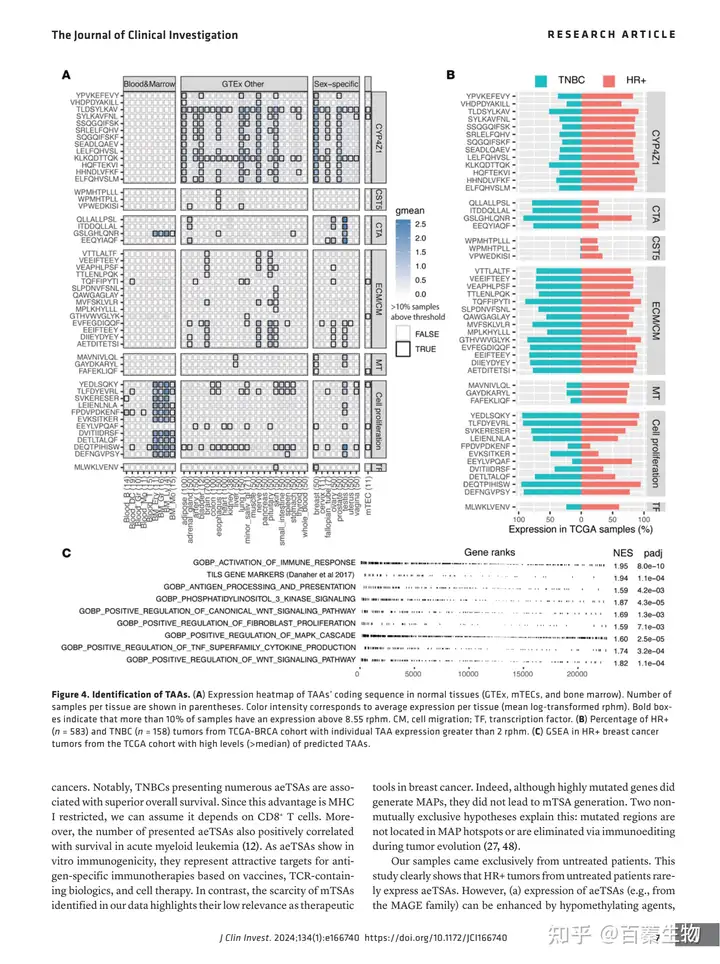
作者鉴定了49种TAAs,其中有48种来源于规范蛋白编码区(图4A),这些抗原在HR+和TNBC肿瘤中都具有高度的共通性(图4B)。14种TAAs来源癌症相关成纤维细胞(CAFs)标志物的基因(COL11A1, COL10A1, LRRC15),这些基因与细胞外基质的产生和细胞迁移有关。13种TAAs来源于CYP4Z1,它与许多癌症类型有关,并在乳腺癌患者中引发自身抗体。11个TAAs与细胞增殖有关(图4B),其在成熟上皮细胞和血细胞中低水平表达,但在骨髓祖细胞中高水平表达(图4A)。使用与aeTSA相同的标准来预测TCGA数据集中每个肿瘤的TAAs数量(图4C)。结果显示高水平TAAs的HR+和TNBC肿瘤存在免疫激活和免疫抑制通路富集,包括PI3K/mTOR、Wnt/B-catenin和MAPK通路。此外,含有大量TAAs的肿瘤显示出成纤维细胞增殖标志物的富集。这些发现表明,在存在多种TAAs的情况下,抗肿瘤免疫反应受到免疫抑制通路的激活和CAFs的积累所调节。
5.TAS和TAAs的免疫原性
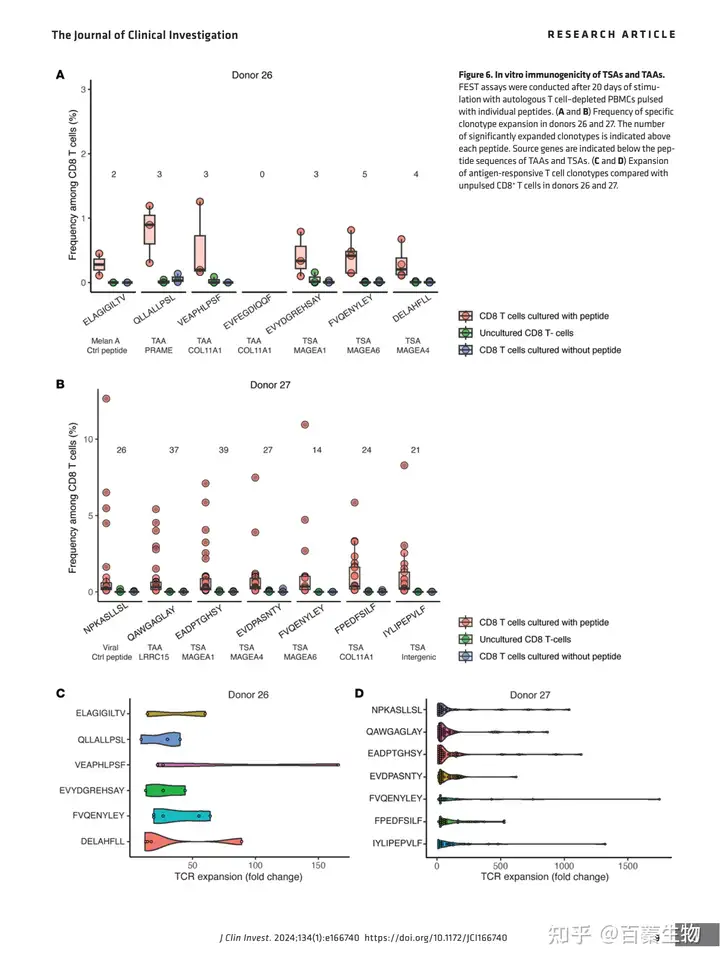
为了评估已鉴定抗原的免疫原性,作者进行了特异性T细胞功能扩增(FEST)试验,检测了2名健康献血者HLA异型呈现的11种不同抗原(7种TSA和4种TAAs)(图6)。阳性对照为免疫原修饰的MelanA drived MAP(ELAGIGILTV)和呼吸道合胞病毒RSV-NL9肽(NPKASLLSL)。结果显示7种TSAs刺激后,TCR Vβ克隆型显著扩增(从3个扩增到39个),4种TAAs中有3个表现出2到37个克隆型的显著扩增,新抗原特异性TCR克隆型的数量与抗肿瘤反应相关。这些结果显示MAP刺激健康受试者后,免疫系统中存在多克隆且功能正常的TAAs和TSAs特异性T细胞,这些细胞对于肿瘤免疫治疗的成功起着重要作用,有助于对抗肿瘤细胞。
6.TAS提高了TNBC患者的总体生存率
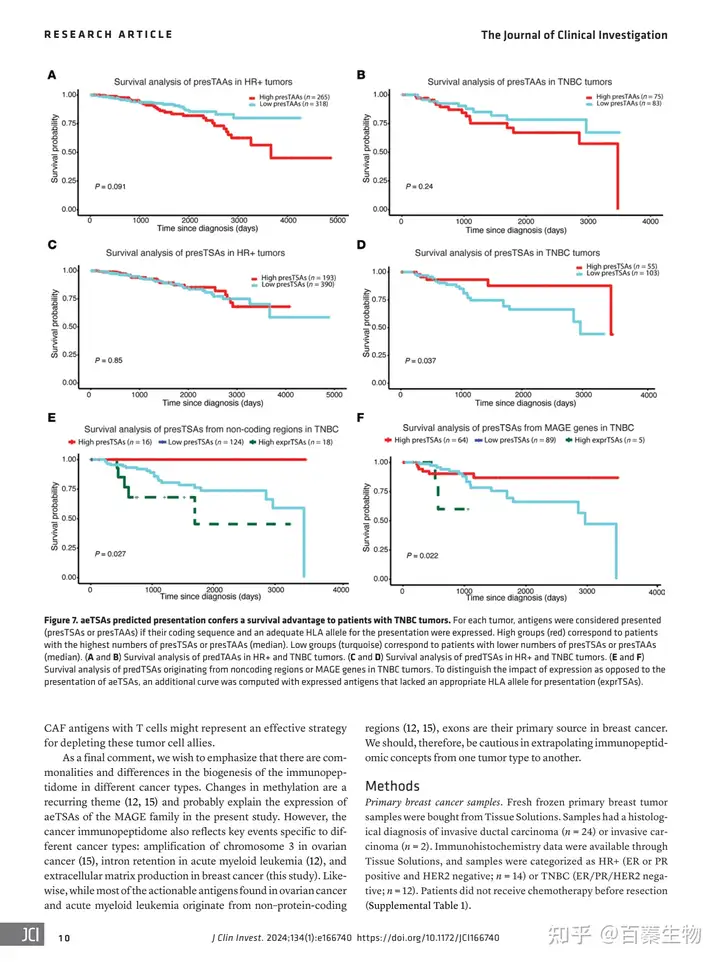
作者进一步评估了TAAs和aeTSAs的数量是否与TCGA患者的总生存率相关,结果显示TAAs的数量对HR+或TNBC肿瘤患者的生存没有影响(图7A,B)。同样,aeTSAs对HR+肿瘤患者也没有影响(图7C)。然而,在TNBC组中,aeTSAs越多,总生存率越高(图7D),从MAGE基因和非编码区提取的aeTSA中也可以观察到这种优势,且这种影响是受HLA限制(图7E,F)。因此可以得出结论,aeTSAs在TNBC患者可以提高生存优势(图7D),而HR+肿瘤中没有这种情况(图7C),可能是因为HR+肿瘤的aeTSAs比TNBC肿瘤更少(图3C)。
结论
本文通过质谱方法及并利用蛋白组学构建个性化数据库对14例激素受体阳性(HR+)和12例三阴性乳腺癌(TNBC)患者的MHC I相关肽进行了分析,鉴定出57094种独特的MAPs,发现了25个TSAs和49个TAAs,这些抗原可作为癌症免疫治疗的潜在靶点,并进一步比较了TNBC和HR+乳腺癌的免疫肽组,二者表现出源基因高度重叠、mTSAs极为罕见、TAAs在两者中大量高度共享这些相似性,也表现出免疫肽组学差异性,即aeTSA经常在TNBC中发现,但很少在HR+肿瘤中发现。这些结果对于了解免疫系统如何识别和攻击乳腺癌细胞以及开发免疫治疗策略具有重要意义。





